 2773
2773
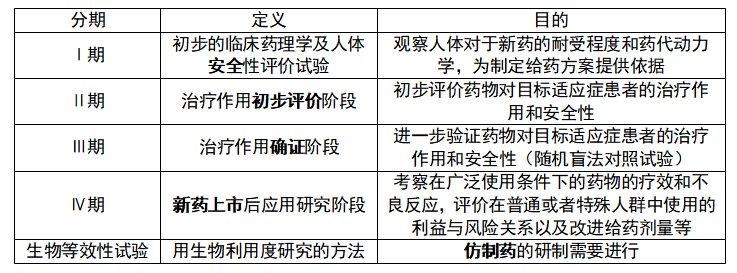
1.临床试验分类
2.国家药品监督管理局主管全国药品注册管理工作,负责建立药品注册管理工作体系和制度,制定药品注册管理规范,依法组织药品注册审评审批以及相关的监督管理工作。
(1)国家药品审评中心负责药物临床试验申请、药品上市许可申请、补充申请和境外生产药品再注册申请等的审评。
(2)省、自治区、直辖市药监部门负责本行政区域内以下药品注册相关管理工作:
①境内生产药品再注册申请的受理、审查和审批;②药品上市后变更的备案、报告事项管理;
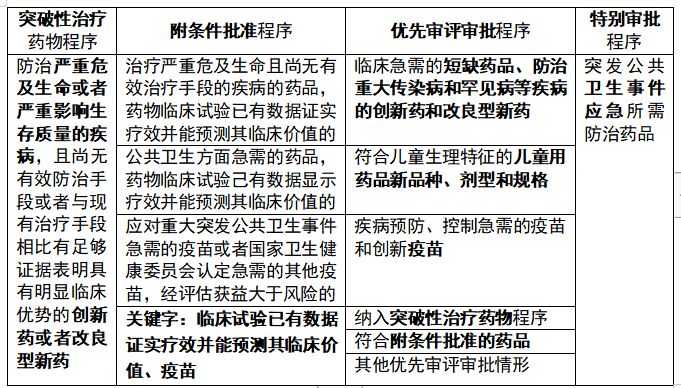
3.加快上市注册程序
4.仿制药注册要求
(1)仿制药是指仿制已上市原研药品的药品,分为两类:一是仿制境外已上市境内未上市原研药品,二是仿制境内已上市原研药品。
(2)如果已上市药品的原研药品无法追溯或者原研药品已经撤市的,应按照新药的要求开展相关研究。
(3)仿制药要求与原研药品具有相同的活性成分、剂型、规格、适应症、给药途径和用法用量,不强调处方工艺与原研药品一致,但强调仿制药品必须与原研药品质量和疗效一致。
5.药品再注册:境内生产药品再注册申请由持有人向其所在地省(区、市)药品监督管理部门提出;境外生产药品再注册申请由持有人向药品审评中心提出。药品注册证书:有效期为5年,在有效期届满前6个月申请药品再注册。
6.药品不予再注册:
①有效期届满前未提出再注册申请的;
②药品注册证书有效期内持有人不能履行持续考察药品质量、疗效和不良反应责任的;
③未在规定时限内完成药品批准证明文件和药监部门要求的研究工作且无合理理由的;
④经上市后评价,属于疗效不确切、不良反应大或者因其他原因危害人体健康的;
⑤法律、行政法规规定的其他不予再注册情形。
7.药品批准文号的格式

8.发明专利权的期限为20年,实用新型专利权的期限为10年,外观设计专利权的期限为15年,均自申请日起计算;为补偿新药上市审评审批占用的时间,对在中国获得上市许可的新药相关发明专利,给予专利权期限补偿,补偿期限不超过5年,新药批准上市后总有效专利权期限不超过14年。
9.药品上市后的变更实行分类管理

10.仿制药质量和疗效一致性评价:对同品种药品通过一致性评价的药品生产企业达到3家以上的,在药品集中采购等方面,原则上不再选用未通过一致性评价的品种;化学药品新注册分类实施前批准上市的含基本药物品种在内的仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价。